–Ы–µ—З–µ–љ–Є–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є

 9732
9732  0
0 –Я–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є—П – –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–µ –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є––і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –≤ —Б—В—А–Њ–µ–љ–Є–Є –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е (—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Є –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е) –Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л—Е –љ–µ–є—А–Њ–љ–Њ–≤, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–Љ–Є –љ–∞ —Д–Њ–љ–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ—А–Є —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ. –Ф–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П –љ–µ–є—А–Њ–њ–∞—В–Є—П (–Ф–Я–Э) – —Н—В–Њ –љ–∞–ї–Є—З–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є/–Є–ї–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–µ—А–≤–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ –њ–Њ—Б–ї–µ –Є—Б–Ї–ї—О—З–µ–љ–Є—П –і—А—Г–≥–Є—Е –њ—А–Є—З–Є–љ [–Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–µ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –њ–Њ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–Љ—Г –≤–µ–і–µ–љ–Є—О –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є, 1995 –≥.].
–†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ф–Я–Э –≤–∞—А—М–Є—А—Г–µ—В –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –Ї—А–Є—В–µ—А–Є–µ–≤, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Ґ–∞–Ї, —З–∞—Б—В–Њ—В–∞ –љ–µ–є—А–Њ–њ–∞—В–Є–Є, –Њ–њ—А–µ–і–µ–ї—П–µ–Љ–Њ–є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 25%, –∞ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Н–ї–µ–Ї—В—А–Њ–Љ–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Г 100% –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ. –Р–љ–∞–ї–Є–Ј —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –≤—Л—П–≤–ї—П–µ–Љ–Њ–є –њ—А–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 50% [8,9].
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ —А–µ–і–Ї–Њ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–∞–±–ї—О–і–∞—О—В—Б—П —Г –і–µ—В–µ–є, –љ–Њ —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Њ–љ–Є –≤—Б—В—А–µ—З–∞—О—В—Б—П –≤—Б–µ —З–∞—Й–µ, –∞ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –±–Њ–ї–µ–µ 5–7 –ї–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є–ї–Є —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П —Г –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞. –°—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е —Б –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–µ–є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ—А–µ–Њ–±–ї–∞–і–∞—О—В –Љ—Г–ґ—З–Є–љ—Л, —З—В–Њ –њ—А–Є–љ—П—В–Њ —Б–≤—П–Ј—Л–≤–∞—В—М —Б —Д–∞–Ї—В–Њ—А–Њ–Љ –Ј–ї–Њ—Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –∞–ї–Ї–Њ–≥–Њ–ї–µ–Љ. –Я—А–Њ–±–ї–µ–Љ–∞ —Б–Њ—З–µ—В–∞–љ–Є—П –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–≥–Њ –Є –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –∞–Ї—В—Г–∞–ї—М–љ–∞, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ —Б–њ–Є—А—В–љ—Л—Е –љ–∞–њ–Є—В–Ї–Њ–≤ –≤—Л–Ј—Л–≤–∞–µ—В —Г –±–Њ–ї—М–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–Њ–Љ –≤—А–µ–Љ–µ–љ–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П –≤ —Б–≤—П–Ј–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–є –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є–Є, —З—В–Њ –љ–µ—А–µ–і–Ї–Њ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ—А–Є—З–Є–љ–Њ–є —А–µ–≥—Г–ї—П—А–љ–Њ–є –∞–ї–Ї–Њ–≥–Њ–ї–Є–Ј–∞—Ж–Є–Є, –∞ –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є – –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±—Л—Б—В—А–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–ї–Ї–Њ–≥–Њ–ї–Є–Ј–Љ–∞ [–Э–µ—А–µ—В–Є–љ –Т.–ѓ. –Є –і—А., 1996].
–Я–Њ –Љ–љ–µ–љ–Є—О P.J. Oates (1997), –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –љ–µ–є—А–Њ–њ–∞—В–Є–Є —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е –°–Ф 1 —В–Є–њ–∞ —П–≤–ї—П—О—В—Б—П —Г—А–Њ–≤–µ–љ—М –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є, –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–∞. –£ –±–Њ–ї—М–љ—Л—Е –°–Ф 2 —В–Є–њ–∞ –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ—О—В —В–∞–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л, –Ї–∞–Ї –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П –Є –љ–∞—А—Г—И–µ–љ–Є–µ –Њ–±–Љ–µ–љ–∞ –ї–Є–њ–Є–і–Њ–≤. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є DCCT (Diabetes Control and Complication Trial) –Є UKPDS (UK Prospective Diabetes Study), —З–∞—Б—В–Њ—В–∞ –≤—Л—П–≤–ї–µ–љ–Є—П –Ф–Я–Э 1–2% –њ—А–Є –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ–Њ–Љ –°–Ф 1 —В–Є–њ–∞ –Є 14–20% –њ—А–Є –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ–Њ–Љ –°–Ф 2 —В–Є–њ–∞.
–Ъ–∞–Ї —Н—В–Њ –љ–Є –њ–∞—А–∞–і–Њ–Ї—Б–∞–ї—М–љ–Њ, –љ–Њ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–µ –љ–µ–≤—А–Њ–њ–∞—В–Є–Є, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М, –і–Є—Б—В–∞–ї—М–љ–∞—П —Б–Є–Љ–Љ–µ—В—А–Є—З–љ–∞—П —Б–µ–љ—Б–Њ–Љ–Њ—В–Њ—А–љ–∞—П –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є—П –≤ –≥–Њ—А–∞–Ј–і–Њ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ —Ж–µ–љ—В—А–∞–ї—М–љ–∞—П –љ–µ–≤—А–Њ–њ–∞—В–Є—П, —Г–≥—А–Њ–ґ–∞–µ—В –Ї–∞—З–µ—Б—В–≤—Г –ґ–Є–Ј–љ–Є –Є —Б–∞–Љ–Њ–є –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –љ–∞–ї–Є—З–Є–µ –Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є (–∞–≤—В–Њ–љ–Њ–Љ–љ–Њ–є) –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –≤—Е–Њ–і—П—Й–µ–є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б —Б–Є–љ–і—А–Њ–Љ–Њ–≤ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є (–Ф–Я–Э), –љ–∞ 50% —Г—Е—Г–і—И–∞–µ—В –њ—А–Њ–≥–љ–Њ–Ј –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е –°–Ф.
–§–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ—Л (–Ф–°) —З—А–µ–≤–∞—В–Њ –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ–Є –∞–Љ–њ—Г—В–∞—Ж–Є—П–Љ–Є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, –∞ –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ —Г –Ї–∞–ґ–і–Њ–≥–Њ –њ—П—В–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ —Б –°–Ф —А–µ–Ј–Ї–Њ —Г—Е—Г–і—И–∞–µ—В –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –µ—Б–ї–Є –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –∞–ї–ї–Њ–і–Є–љ–Є–µ–є (–њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –±–Њ–ї–Є –≤ –Њ—В–≤–µ—В –љ–∞ –љ–µ–±–Њ–ї–µ–≤—Л–µ —Б—В–Є–Љ—Г–ї—Л). –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Њ—В 40 –і–Њ 70% –≤—Б–µ—Е –љ–µ—В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –∞–Љ–њ—Г—В–∞—Ж–Є–є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Г –±–Њ–ї—М–љ—Л—Е –°–Ф, –њ–Њ—Н—В–Њ–Љ—Г –Ї—А–∞–є–љ–µ –≤–∞–ґ–љ–Њ –≤–Њ–≤—А–µ–Љ—П –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞—В—М –Є –њ—А–Є–љ—П—В—М —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ –Љ–µ—А—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П.
–°—Г—Й–µ—Б—В–≤—Г–µ—В –Љ–љ–µ–љ–Є–µ, —З—В–Њ —В–µ –Є–ї–Є –Є–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є–Љ–µ—О—В –Љ–µ—Б—В–Њ —Г –Ї–∞–ґ–і–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ, –њ–Њ—Н—В–Њ–Љ—Г –Ї–Њ—А—А–µ–Ї—В–љ–µ–µ —В—А–∞–Ї—В–Њ–≤–∞—В—М —Н—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–µ –Ї–∞–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, –∞ –Ї–∞–Ї –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Я–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—П –Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –љ–µ—А–≤–Њ–≤ —П–≤–ї—П—О—В—Б—П —Б–Љ–µ—И–∞–љ–љ—Л–Љ–Є –Є —Б–Њ–і–µ—А–ґ–∞—В –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л–µ, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–µ –Є –∞–≤—В–Њ–љ–Њ–Љ–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞. –Я–Њ—Н—В–Њ–Љ—Г —Б–Є–Љ–њ—В–Њ–Љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б –њ–Њ—А–∞–ґ–µ–љ–Є—П –љ–µ—А–≤–∞ —Б–Ї–ї–∞–і—Л–≤–∞–µ—В—Б—П –Є–Ј –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Є –∞–≤—В–Њ–љ–Њ–Љ–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤. –Т—Л–і–µ–ї—П—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —В–Є–њ–Њ–≤ –≤–Њ–ї–Њ–Ї–Њ–љ, –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–Є–∞–Љ–µ—В—А–∞ –Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ—А–Њ–≤–Њ–і–Є–Љ—Л—Е –Є–Љ–њ—Г–ї—М—Б–Њ–≤ [11].
–Ъ–∞–ґ–і—Л–є –∞–Ї—Б–Њ–љ –ї–Є–±–Њ –њ–Њ–Ї—А—Л—В –Њ–±–Њ–ї–Њ—З–Ї–Њ–є —И–≤–∞–љ–љ–Њ–≤—Б–Ї–Њ–є –Ї–ї–µ—В–Ї–Є – –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –≤–Њ–ї–Њ–Ї–љ–Њ –љ–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–µ–Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ, –ї–Є–±–Њ –Њ–Ї—А—Г–ґ–µ–љ –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Є –ї–µ–ґ–∞—Й–Є–Љ–Є –Љ–µ–Љ–±—А–∞–љ–∞–Љ–Є —И–≤–∞–љ–љ–Њ–≤—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї – –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –≤–Њ–ї–Њ–Ї–љ–Њ –љ–∞–Ј—Л–≤–∞–µ—В—Б—П –Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ. –Э–µ—А–≤ —Б–Њ–і–µ—А–ґ–Є—В –Ї–∞–Ї –Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ, —В–∞–Ї –Є –љ–µ–Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞. –Ґ–Њ–ї—М–Ї–Њ –љ–µ–Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ —Б–Њ–і–µ—А–ґ–∞—В –∞–≤—В–Њ–љ–Њ–Љ–љ—Л–µ —Н—Д—Д–µ—А–µ–љ—В–љ—Л–µ –Є —З–∞—Б—В—М —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –∞—Д—Д–µ—А–µ–љ—В–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ.
–Ґ–Њ–ї—Б—В—Л–µ –Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –њ—А–Њ–≤–Њ–і—П—В –≤–Є–±—А–∞—Ж–Є—О –Є –њ—А–Њ–њ—А–Є–Њ—Ж–µ–њ—Ж–Є—О. –Ґ–Њ–љ–Ї–Є–µ –Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –Є –љ–µ–Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —З—Г–≤—Б—В–≤–∞ –±–Њ–ї–Є, –њ—А–Є–Ї–Њ—Б–љ–Њ–≤–µ–љ–Є—П, —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л. –Ю—Б–љ–Њ–≤–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –љ–µ—А–≤–љ–Њ–≥–Њ –≤–Њ–ї–Њ–Ї–љ–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Є–Љ–њ—Г–ї—М—Б–∞.
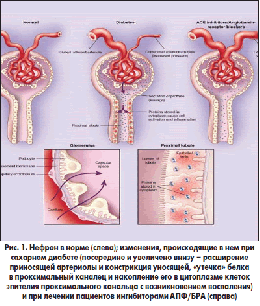
–Я–∞—В–Њ–≥–µ–љ–µ–Ј –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є –≥–µ—В–µ—А–Њ–≥–µ–љ–µ–љ –Є –Љ—Г–ї—М—В–Є—Д–∞–Ї—В–Њ—А–µ–љ. –Т –Њ—Б–љ–Њ–≤–µ –ї–µ–ґ–Є—В –њ—А–Њ–≥—А–µ—Б—Б–Є–≤–љ–∞—П –њ–Њ—В–µ—А—П –Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ – —Б–µ–≥–Љ–µ–љ—В–љ–∞—П –і–µ–Љ–Є–µ–ї–Є–љ–Є–Ј–∞—Ж–Є—П –Є –∞–Ї—Б–Њ–љ–∞–ї—М–љ–∞—П –і–µ–≥–µ–љ–µ—А–∞—Ж–Є—П, –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ – –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –љ–µ—А–≤–љ–Њ–≥–Њ –Є–Љ–њ—Г–ї—М—Б–∞.
–Ъ–ї—О—З–µ–≤—Г—О —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –љ–µ–є—А–Њ–њ–∞—В–Є–Є –Є–≥—А–∞–µ—В —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—П. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ DCCT –і–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –Є–Љ–µ–љ–љ–Њ –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—П –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–∞ –Ј–∞ —А–∞–Ј–≤–Є—В–Є–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є [10]. –У–ї—О–Ї–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ —Б—Г–±—Б—В—А–∞—В–Њ–Љ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є, –њ—А–Є—З–µ–Љ –µ–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—Г—В–µ–Љ –і–Є—Д—Д—Г–Ј–Є–Є –Є –љ–µ —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ. –Т—Б–ї–µ–і—Б—В–≤–Є–µ —Н—В–Њ–≥–Њ –Њ–і–љ–Є–Љ –Є–Ј –Ј–≤–µ–љ—М–µ–≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –≥–ї—О–Ї–Њ–Ј–Њ—В–Њ–Ї—Б–Є—З–љ—Л–є —Н—Д—Д–µ–Ї—В –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є.
–Ф—А—Г–≥–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є —А–∞–Ј–≤–Є—В–Є—П –Ф–Я–Э —П–≤–ї—П—О—В—Б—П:
– –Љ–Є–Ї—А–Њ–∞–љ–≥–Є–Њ–њ–∞—В–Є—П (–Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Љ–µ–ї–Ї–Є—Е —Б–Њ—Б—Г–і–Њ–≤, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є vasa nervorum) –Ј–∞ —Б—З–µ—В –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –Э–Я–Э–Я –≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–µ, –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Я–Ю–Ы —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Б–≤–Њ–±–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤, –њ–Њ–і–∞–≤–ї–µ–љ–Є—О —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–Њ—Ж–Є–Ї–ї–Є–љ–∞, –Њ–±–ї–∞–і–∞—О—Й–µ–≥–Њ –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ—Л–Љ –Є —Б–Њ—Б—Г–і–Њ—А–∞—Б—И–Є—А—П—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ;
– –≥–Є–њ–Њ–Ї—Б–Є—П –љ–µ—А–≤–Њ–≤, —А–∞–Ј–≤–Є—В–Є–µ –Ї–Њ—В–Њ—А–Њ–є –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Њ–њ—А–µ–і–µ–ї—П–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Љ–Є–Ї—А–Њ–∞–љ–≥–Є–Њ–њ–∞—В–Є–Є. –Ґ–∞–Ї–ґ–µ –њ—А–Є—З–Є–љ–Њ–є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Н–љ–і–Њ–љ–µ–≤—А–∞–ї—М–љ–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–Є –њ—А–Є –Ф–Я–Э —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –≥–Є–±–Ї–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –≤—П–Ј–Ї–Њ—Б—В–Є –Ї—А–Њ–≤–Є, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Н–љ–і–Њ–љ–µ–≤—А–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Љ–Є–Ї—А–Њ—В—А–Њ–Љ–±–Њ–≤ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Н–љ–і–Њ–љ–µ–≤—А–∞–ї—М–љ–Њ–≥–Њ –Њ—В–µ–Ї–∞;
– –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ —Б–і–≤–Є–≥–Є – –Є–Ј–±—Л—В–Њ–Ї –≥–ї—О–Ї–Њ–Ј—Л –њ—А–µ–≤—А–∞—Й–∞–µ—В—Б—П –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –∞–ї—М–і–Њ–Ј–Њ—А–µ–і—Г–Ї—В–∞–Ј—Л –≤–Њ —Д—А—Г–Ї—В–Њ–Ј—Г –Є —Б–Њ—А–±–Є—В–Њ–ї – –Њ–±—А–∞–Ј—Г–µ—В—Б—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є «–њ–Њ–ї–Є–Њ–ї–Њ–≤—Л–є —И—Г–љ—В»; –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ —Н—В–Є—Е –≤–µ—Й–µ—Б—В–≤ –≤ –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –≤—Л–Ј—Л–≤–∞–µ—В –Є—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ;
– –≥–ї–Є–Ї–Є—А–Њ–≤–∞–љ–Є–µ –±–µ–ї–Ї–Њ–≤. –У–ї–Є–Ї–Є—А–Њ–≤–∞–љ–Є–µ – —Н—В–Њ —А–µ–∞–Ї—Ж–Є—П –Ї–Њ–љ–і–µ–љ—Б–∞—Ж–Є–Є –Љ–µ–ґ–і—Г –∞–ї—М–і–µ–≥–Є–і–љ–Њ–є –≥—А—Г–њ–њ–Њ–є (–≥–ї—О–Ї–Њ–Ј–∞, —Д—А—Г–Ї—В–Њ–Ј–∞ –Є –і—А.) –Є –∞–Љ–Є–љ–Њ–≥—А—Г–њ–њ–Њ–є (–љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –ї–Є–Ј–Є–љ–∞). –Я—А–Є –Ф–Я–Э –Є–і–µ—В –њ—А–Њ—Ж–µ—Б—Б –≥–ї–Є–Ї–Є—А–Њ–≤–∞–љ–Є—П –Љ–Є–µ–ї–Є–љ–∞, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —З–µ–≥–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –і–µ–Љ–Є–µ–ї–Є–љ–Є–Ј–∞—Ж–Є—П –Є –љ–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Љ–Є–µ–ї–Є–љ–∞, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —З–µ–≥–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –і–µ–Љ–Є–µ–ї–Є–љ–µ–Ј–∞—Ж–Є—П –Є –љ–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ;
– –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ—Л–є —Б—В—А–µ—Б—Б – –і–Є—Б–±–∞–ї–∞–љ—Б –њ—А–Њ–Њ–Ї—Б–Є–і–∞–љ—В–Њ–≤ –Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ–Њ–≤ –≤ –њ–Њ–ї—М–Ј—Г –њ–µ—А–≤—Л—Е, —З—В–Њ –≤–µ–і–µ—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Н–љ–і–Њ–љ–µ–≤—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Є —А–∞–Ј–≤–Є—В–Є—О –Є—И–µ–Љ–Є–Є –љ–µ—А–≤–∞;
– –і–µ—Д–Є—Ж–Є—В —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ —А–µ–ї–∞–Ї—Б–Є—А—Г—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ – –Њ–Ї—Б–Є–і –∞–Ј–Њ—В–∞ (NO) —П–≤–ї—П–µ—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л–Љ –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–Љ. –°–љ–Є–ґ–µ–љ–Є–µ –µ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –њ—А–Є–≤–Њ–і–Є—В –Ї –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—Ж–Є–Є, –Є—И–µ–Љ–Є–Є –Є –Ј–∞–Љ–µ–і–ї–µ–љ–Є—О —Б–Ї–Њ—А–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –љ–µ—А–≤–љ–Њ–≥–Њ –Є–Љ–њ—Г–ї—М—Б–∞;
– –і–µ—Д–Є—Ж–Є—В a––ї–Є–њ–Њ–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –Њ–±–ї–∞–і–∞—О—Й–µ–є –Љ–Њ—Й–љ—Л–Љ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ. a––ї–Є–њ–Њ–µ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ –њ–Њ–≤—Л—И–∞–µ—В –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –≥–ї—О–Ї–Њ–Ј—Л –≤ –Є–љ—Б—Г–ї–Є–љ–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Є –Є–љ—Б—Г–ї–Є–љ–љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —В–Ї–∞–љ—П—Е, —Г–≤–µ–ї–Є—З–Є–≤–∞—П –њ–Њ–≥–ї–Њ—Й–µ–љ–Є–µ –≥–ї—О–Ї–Њ–Ј—Л –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–Љ–Є –љ–µ—А–≤–∞–Љ–Є –і–Њ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П, –∞ —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є—О —Н–љ–і–Њ–љ–µ–≤—А–∞–ї—М–љ—Л—Е –Ј–∞–њ–∞—Б–Њ–≤ –≥–ї—О–Ї–Њ–Ј—Л, —З—В–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ —Б–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–∞ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –љ–µ—А–≤–Њ–≤;
– –Є –і—А.
–Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П (—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–Ї–∞ –і–Є–∞–≥–љ–Њ–Ј–∞) –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є [6]:
–Я–Њ—А–∞–ґ–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л:
– —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П;
– –Љ–Є–µ–ї–Њ–њ–∞—В–Є—П.
–Я–Њ—А–∞–ґ–µ–љ–Є–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л:
l –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є—П
– —Б–µ–љ—Б–Њ—А–љ–∞—П —Д–Њ—А–Љ–∞ (—Б–Є–Љ–Љ–µ—В—А–Є—З–љ–∞—П, –љ–µ—Б–Є–Љ–Љ–µ—В—А–Є—З–љ–∞—П) – –љ–Њ—З–љ—Л–µ —Б—Г–і–Њ—А–Њ–≥–Є –Є–Ї—А–Њ–љ–Њ–ґ–љ—Л—Е –Љ—Л—И—Ж, –њ–Њ–Ї–∞–ї—Л–≤–∞–љ–Є–µ, –ґ–ґ–µ–љ–Є–µ, –Ј—П–±–Ї–Њ—Б—В—М –љ–Њ–≥, –Њ–љ–µ–Љ–µ–љ–Є–µ, –Њ—Й—Г—Й–µ–љ–Є–µ –њ–Њ–ї–Ј–∞–љ—М—П –Љ—Г—А–∞—И–µ–Ї, –Љ–Њ–ґ–ґ–µ–љ–Є–µ;
– –Љ–Њ—В–Њ—А–љ–∞—П —Д–Њ—А–Љ–∞ (—Б–Є–Љ–Љ–µ—В—А–Є—З–љ–∞—П, –љ–µ—Б–Є–Љ–Љ–µ—В—А–Є—З–љ–∞—П) – —Б–ї–∞–±–Њ—Б—В—М, –∞—В—А–Њ—Д–Є—П –Љ—Л—И—Ж –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є;
– —Б–µ–љ—Б–Њ–Љ–Њ—В–Њ—А–љ–∞—П —Д–Њ—А–Љ–∞ (—Б–Є–Љ–Љ–µ—В—А–Є—З–љ–∞—П, –љ–µ—Б–Є–Љ–Љ–µ—В—А–Є—З–љ–∞—П);
l –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –Љ–Њ–љ–Њ–љ–µ–є—А–Њ–њ–∞—В–Є—П (–Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –њ—А–Њ–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є —З–µ—А–µ–њ–љ—Л—Е –Є–ї–Є —Б–њ–Є–љ–љ–Њ–Љ–Њ–Ј–≥–Њ–≤—Л—Е –љ–µ—А–≤–Њ–≤);
l –∞–≤—В–Њ–љ–Њ–Љ–љ–∞—П (–≤–µ–≥–µ—В–∞—В–Є–≤–љ–∞—П) –љ–µ–є—А–Њ–њ–∞—В–Є—П:
– –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П —Д–Њ—А–Љ–∞ – –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ –њ—А–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–Є –њ–Њ–ї–Њ–ґ–µ–љ–Є—П —В–µ–ї–∞, –Њ—А—В–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–∞—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є—П > 30 mmHg;
– –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ–∞—П —Д–Њ—А–Љ–∞ – —З—Г–≤—Б—В–≤–Њ –њ–µ—А–µ–њ–Њ–ї–љ–µ–љ–Є—П –ґ–µ–ї—Г–і–Ї–∞, —А–≤–Њ—В–∞ —Б—К–µ–і–µ–љ–љ–Њ–є –љ–∞–Ї–∞–љ—Г–љ–µ –њ–Є—Й–µ–є;
– —Г—А–Њ–≥–µ–љ–Є—В–∞–ї—М–љ–∞—П —Д–Њ—А–Љ–∞ – –і–Є–Ј—Г—А–Є—П, –Є–Љ–њ–Њ—В–µ–љ—Ж–Є—П;
– –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–∞—П –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—П –Є –і—А.
–Ю—В–і–µ–ї—М–љ–Њ, –љ–Њ —В–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –Ф–Я–Э —П–≤–ї—П–µ—В—Б—П —Б–Є–љ–і—А–Њ–Љ «–Ф–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П —Б—В–Њ–њ–∞» – –Є–љ—Д–µ–Ї—Ж–Є—П, —П–Ј–≤–∞ –Є/–Є–ї–Є –і–µ—Б—В—А—Г–Ї—Ж–Є—П –≥–ї—Г–±–Њ–Ї–Є—Е —В–Ї–∞–љ–µ–є, —Б–≤—П–Ј–∞–љ–љ–∞—П —Б –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –Є —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Љ–∞–≥–Є—Б—В—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –∞—А—В–µ—А–Є—П—Е –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є (–љ–∞ –Њ—Б–љ–Њ–≤–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Т–Ю–Ч).
–Ь–µ—В–Њ–і—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1.
–°–Є–љ–і—А–Њ–Љ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ—Л (–°–Ф–°) –Њ–±—К–µ–і–Є–љ—П–µ—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –Є –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–µ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Г—О —Г–≥—А–Њ–Ј—Г —А–∞–Ј–≤–Є—В–Є—П —П–Ј–≤–µ–љ–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є –≥–∞–љ–≥—А–µ–љ—Л —Б—В–Њ–њ—Л [–Ф–µ–і–Њ–≤ –Ш.–Ш. –Є —Б–Њ–∞–≤—В., 1998] [1].
–§–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –°–Ф–°:
– –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є—П;
– –њ–Њ—А–∞–ґ–µ–љ–Є–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –ї—О–±–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞;
– –і–µ—Д–Њ—А–Љ–∞—Ж–Є—П —Б—В–Њ–њ –ї—О–±–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞;
– –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –љ–µ—Д—А–Њ–њ–∞—В–Є—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –•–Я–Э;
– –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ј—А–µ–љ–Є—П, —Б–ї–µ–њ–Њ—В–∞;
– –Њ–і–Є–љ–Њ—З–љ–Њ–µ –њ—А–Њ–ґ–Є–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤;
– –Ј–ї–Њ—Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–ї–Ї–Њ–≥–Њ–ї–µ–Љ;
– –Ї—Г—А–µ–љ–Є–µ.
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є—П —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–≤–µ–љ–∞ –≤ —А–∞–Ј–≤–Є—В–Є–Є —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ–Њ–≥–Њ –°–Ф –≤—Л–і–µ–ї—П—О—В —В—А–Є –Њ—Б–љ–Њ–≤–љ—Л—Е —Д–Њ—А–Љ—Л –°–Ф–°:
– –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї—Г—О;
– –Є—И–µ–Љ–Є—З–µ—Б–Ї—Г—О;
– –љ–µ–є—А–Њ––Є—И–µ–Љ–Є—З–µ—Б–Ї—Г—О (—Б–Љ–µ—И–∞–љ–љ—Г—О).
–Ы–µ—З–µ–љ–Є–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є
–Ф–Є–∞–≥–љ–Њ–Ј –Є –ї–µ—З–µ–љ–Є–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ—А–Њ–±–ї–µ–Љ—Г –≤–Њ –≤—А–∞—З–µ–±–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ, –Ї–Њ—В–Њ—А—Г—О —З–∞—Б—В–Њ –љ–µ–і–Њ–Њ—Ж–µ–љ–Є–≤–∞—О—В.
–І—В–Њ–±—Л –Є—Б–Ї–ї—О—З–Є—В—М –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Є–Ј––Ј–∞ —Б–ї–Є—И–Ї–Њ–Љ –њ–Њ–Ј–і–љ–µ–≥–Њ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–∞–љ–љ–µ–µ —А–∞—Б–њ–Њ–Ј–љ–∞–≤–∞–љ–Є–µ – —В–Њ –µ—Б—В—М —А–∞–љ–љ–Є–є –њ–Њ–≤—В–Њ—А–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –ї–Є—Ж, —Б—В—А–∞–і–∞—О—Й–Є—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ, –Є, –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є, —Б–∞–Љ–∞—П —А–∞–љ–љ—П—П –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–∞ –і–Є–∞–≥–љ–Њ–Ј–∞ –Ф–Я–Э.
–£—З–Є—В—Л–≤–∞—П —А–Њ–ї—М –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ф–Я–Э, –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ –љ–Њ—А–Љ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Ф–Я–Э.
–Я–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –љ–Њ—А–Љ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Ф–Я–Э –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–∞–і–µ—А–ґ–Ї–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –љ–µ—А–≤–Њ–≤, –љ–Њ –љ–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±—Л—Б—В—А–Њ–є –ї–Є–Ї–≤–Є–і–∞—Ж–Є–Є –µ–µ –њ—А–Њ—П–≤–ї–µ–љ–Є–є.
–Ч–і–µ—Б—М –≤–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Г—А–Њ–≤–љ—П –≥–ї–Є–Ї–µ–Љ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–ґ–µ—В —Г—Б–Є–ї–Є–≤–∞—В—М—Б—П –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ (–Є–ї–Є –њ–Њ—П–≤–ї—П—В—М—Б—П, –µ—Б–ї–Є —В–∞–Ї–Њ–≤–∞—П –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–∞ —А–∞–љ–µ–µ). –≠—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —Б –Њ–±—А–∞—В–љ—Л–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ —В–µ—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ–Є–Ј–Њ—И–ї–Є –≤ –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–љ–∞—Е. –≠—В–Њ —Г—Е—Г–і—И–µ–љ–Є–µ –љ–Њ—Б–Є—В –њ—А–µ—Е–Њ–і—П—Й–Є–є —Е–∞—А–∞–Ї—В–µ—А, —В–Њ –µ—Б—В—М –≤—А–µ–Љ–µ–љ–љ—Л–є, –Є –њ—А–Њ—Е–Њ–і–Є—В –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –љ–µ–і–µ–ї—М –Є–ї–Є –Љ–µ—Б—П—Ж–µ–≤ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –±–ї–Є–Ј–Ї–Њ–≥–Њ –Ї –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ—Г —Г—А–Њ–≤–љ—П –≥–ї–Є–Ї–µ–Љ–Є–Є [2].
–Ю–і–љ–∞–Ї–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ —В–Њ–ї—М–Ї–Њ –љ–Њ—А–Љ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –љ–µ —Б–њ–Њ—Б–Њ–±–љ–Њ –±—Л—Б—В—А–Њ –ї–Є–Ї–≤–Є–і–Є—А–Њ–≤–∞—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Ф–Я–Э, —Б–љ–Є–ґ–∞—О—Й–Є–µ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —В—А–µ–±—Г–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ, –Њ—Б–Њ–±–µ–љ–љ–Њ –і–ї—П —Б–љ—П—В–Є—П –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —В–Є–Њ–Ї—В–Њ–≤–∞—П (a––ї–Є–њ–Њ–µ–≤–∞—П) –Ї–Є—Б–ї–Њ—В–∞, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Ґ–Є–Њ–≥–∞–Љ–Љ–∞, —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –≤ –ї–µ—З–µ–љ–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є, —З—В–Њ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є —И–Є—А–Њ–Ї–Њ–Љ–∞—Б—И—В–∞–±–љ—Л–µ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л–µ –Љ–љ–Њ–≥–Њ–ї–µ—В–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —В–∞–Ї–Є–µ –Ї–∞–Ї ALADIN Study (Alpha–Lipoic Acid in Diabetic Neuropathy) [7]. –Ґ–∞–Ї–ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ґ–Є–Њ–≥–∞–Љ–Љ—Л –њ—А–Є –Ф–Я–Э –±—Л–ї–∞ —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≤–Њ –Љ–љ–Њ–≥–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –≤ –Ї–∞—З–µ—Б—В–≤–µ –љ–∞–Є–±–Њ–ї–µ–µ —В–Є–њ–Є—З–љ–Њ–≥–Њ –Љ–Њ–ґ–љ–Њ –њ—А–Є–≤–µ—Б—В–Є —А–∞–±–Њ—В—Г, –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Г—О –Ї–Њ–ї–ї–µ–Ї—В–Є–≤–Њ–Љ –∞–≤—В–Њ—А–Њ–≤ –Є–Ј –°–Њ—Д–Є–є—Б–Ї–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ –њ–Њ–і —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ–Љ –Ґ. –Ґ–∞–љ–Ї–Њ–≤–Њ–є (2000 –≥.). –Ю—В–Ї—А—Л—В–Њ–µ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –љ–∞ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е. –Ы–µ—З–µ–љ–Є–µ –Ґ–Є–Њ–≥–∞–Љ–Љ–Њ–є –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ–Њ –Њ–±—Л—З–љ–Њ–є —Б—Е–µ–Љ–µ: –њ–Њ—Б–ї–µ –њ–µ—А–Є–Њ–і–∞ –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л—Е –Є–љ—Д—Г–Ј–Є–є –Њ–љ–∞ –љ–∞–Ј–љ–∞—З–∞–ї–∞—Б—М –≤–љ—Г—В—А—М. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М –њ–Њ—Б—В–Њ—П–љ–љ–∞—П –і–Њ–Ј–∞ 600 –Љ–≥ –≤ —Б—Г—В–Ї–Є; –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Њ—Б—М –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є, –њ—А–Є–µ–Љ –≤–љ—Г—В—А—М – 50 –і–љ–µ–є.
–°—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Њ—В–Љ–µ—З–∞–ї—Б—П —Г–ґ–µ –њ–Њ—Б–ї–µ –њ–µ—А–≤—Л—Е 10 –і–љ–µ–є —В–µ—А–∞–њ–Є–Є. –Ґ–∞–Ї, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ґ–Є–Њ–≥–∞–Љ–Љ—Г, –љ–∞ 40% —Б–љ–Є–Ј–Є–ї–∞—Б—М –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М —Б–њ–Њ–љ—В–∞–љ–љ—Л—Е –±–Њ–ї–µ–≤—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є –≤ –љ–Њ–≥–∞—Е, –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ–∞—П –≤ –±–∞–ї–ї–∞—Е –њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ (–њ–Њ McGill); –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 35%. –Т–Њ–Ј—А–Њ—Б–ї–∞ –≤–Є–±—А–∞—Ж–Є–Њ–љ–љ–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–µ–љ–љ–∞—П –і–Њ –ї–µ—З–µ–љ–Є—П, –Њ–њ—А–µ–і–µ–ї—П–≤—И–∞—П—Б—П –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–Њ–љ–∞—Е. –Ъ –Ї–Њ–љ—Ж—Г –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є —Н—В–∞ –і–Є–љ–∞–Љ–Є–Ї–∞ –±—Л–ї–∞ –µ—Й–µ –Ј–∞–Љ–µ—В–љ–µ–µ: –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–µ–є —Г–њ–∞–ї–∞ –±–Њ–ї–µ–µ —З–µ–Љ –≤ 4 —А–∞–Ј–∞, –∞ –≤–Є–±—А–∞—Ж–Є–Њ–љ–љ–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –≤–Њ–Ј—А–Њ—Б–ї–∞ –≤ 1,6–2,2 —А–∞–Ј–∞. –Ч–∞ —Н—В–Њ –≤—А–µ–Љ—П —З–Є—Б–ї–Њ –±–Њ–ї—М–љ—Л—Е —Б —Б–Њ—Е—А–∞–љ–љ–Њ–є —В–∞–Ї—В–Є–ї—М–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —А–∞—Б–њ–Њ–Ј–љ–∞–≤–∞—В—М —Е–Њ–ї–Њ–і –Є —В–µ–њ–ї–Њ —Г–≤–µ–ї–Є—З–Є–ї–Њ—Б—М –≤ 3 –Є 4 —А–∞–Ј–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–°—В–Њ–ї—М –ґ–µ –љ–∞–≥–ї—П–і–љ–∞ –Є –і–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е —В—П–ґ–µ—Б—В—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л: –Ј–∞ 60 –і–љ–µ–є —В–µ—А–∞–њ–Є–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є —Б–Њ–Ї—А–∞—В–Є–ї–Є—Б—М –љ–∞ 40% –Є –≤ 2,5 —А–∞–Ј–∞ —Г–Љ–µ–љ—М—И–Є–ї–Њ—Б—М –њ–∞–і–µ–љ–Є–µ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –њ—А–Є –Њ—А—В–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ–±–µ. –≠—В–∞ –і–Є–љ–∞–Љ–Є–Ї–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П –Є–љ–і–µ–Ї—Б–∞ –Т–∞–ї—М—Б–∞–ї—М–≤—Л –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —В–µ—Б—В–∞ —Б –≥–ї—Г–±–Њ–Ї–Є–Љ –і—Л—Е–∞–љ–Є–µ–Љ –Є–Љ–µ–ї–Є –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є —Б–Љ—Л—Б–ї.
–Ч–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ —В–∞–Ї–ґ–µ –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ —Б–µ—А–Є—П —А–∞–±–Њ—В –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ґ–Є–Њ–≥–∞–Љ–Љ—Л –њ—А–Є –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є [–Р.–°. –Р–Љ–µ—В–Њ–≤ —Б —Б–Њ–≤–∞—В., 1999; –§.–Х. –У–Њ—А–±–∞—З–µ–≤ —Б —Б–Њ–∞–≤—В., 2000; –Ш.–Ш. –Ф–µ–і–Њ–≤ —Б —Б–Њ–∞–≤—В., 1999; –Ш.–Ь. –Ъ–∞—Е–љ–Њ–≤—Б–Ї–Є–є —Б —Б–Њ–∞–≤—В.. 1999]. –Т –љ–Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М —В–µ –ґ–µ –і–Њ–Ј—Л, –љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є–љ–Њ–є —А–µ–ґ–Є–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞: –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–µ –Є–љ—Д—Г–Ј–Є–Є –Є –њ—А–Є–µ–Љ –≤–љ—Г—В—А—М –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є—Б—М —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –љ–µ 10 –Є 50 –і–љ–µ–є, –∞ –њ–Њ 3 –љ–µ–і–µ–ї–Є. –Ю–±—Й–∞—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї—Г—А—Б–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ –≤ —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ 42 –і–љ—П. –Ф–∞–љ–љ—Л–µ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –љ–∞—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Є —Б –і–∞–љ–љ—Л–Љ–Є –°–Њ—Д–Є–є—Б–Ї–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞. –Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —Б–Ї–Њ—А–Њ—Б—В–Є –љ–∞—А–∞—Б—В–∞–љ–Є—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є –≤ –Њ–±–Њ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –ї—Г—З—И–Є–µ –і–∞–љ–љ—Л–µ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л —Г —В–µ—Е –≥—А—Г–њ–њ –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ—Б–ї–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–ї—Г—З–∞–ї–Є –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ—Л–є –Ї—Г—А—Б –Ґ–Є–Њ–≥–∞–Љ–Љ—Л –≤ —В–∞–±–ї–µ—В–Ї–∞—Е. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–і–µ–ї–∞—В—М –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є —Г–і–ї–Є–љ–µ–љ–Є–Є —Б—А–Њ–Ї–Њ–≤ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ґ–Є–Њ–≥–∞–Љ–Љ–Њ–є –љ–∞—А–∞—Б—В–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є.
–Ґ–Є–Њ–Ї—В–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞, –љ–∞–Ї–∞–њ–ї–Є–≤–∞—П—Б—М –≤ –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–љ–∞—Е:
– —Б–љ–Є–ґ–∞–µ—В —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —Б–≤–Њ–±–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤,
– —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Н–љ–і–Њ–љ–µ–≤—А–∞–ї—М–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї;
– –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В—Б—П —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ NO, —А–µ–≥—Г–ї—П—В–Њ—А–∞ —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є (–µ—Б–ї–Є –µ–≥–Њ –Љ–љ–Њ–≥–Њ, –Ї–∞–Ї –њ—А–Є –°–Ф, —В–Њ –Њ–љ –љ–∞—З–Є–љ–∞–µ—В –і–µ–є—Б—В–≤–Њ–≤–∞—В—М –Ї–∞–Ї —Б–≤–Њ–±–Њ–і–љ—Л–є —А–∞–і–Є–Ї–∞–ї);
– —Г–ї—Г—З—И–∞–µ—В —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О;
– —Б–љ–Є–ґ–∞–µ—В —Г—А–Њ–≤–µ–љ—М –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Г—А–Њ–≤–µ–љ—М –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–є —Д—А–∞–Ї—Ж–Є–Є –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ –Ы–Я–Т–Я.
–Ф—А—Г–≥–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —В–Є–Њ–Ї—В–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —П–≤–ї—П—О—В—Б—П: –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–∞—П, —В–Њ–Ї—Б–Є—З–µ—Б–Ї–∞—П (—Н–Ї–Ј–Њ–≥–µ–љ–љ–∞—П –Є —Н–љ–і–Њ–≥–µ–љ–љ–∞—П) –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є—П; —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –≤–Є—А—Г—Б–љ—Л–є –≥–µ–њ–∞—В–Є—В, —Ж–Є—А—А–Њ–Ј –њ–µ—З–µ–љ–Є, –Њ—В—А–∞–≤–ї–µ–љ–Є–µ –≥–µ–њ–∞—В–Њ—В—А–Њ–њ–љ—Л–Љ–Є —П–і–∞–Љ–Є; –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј, –≥–Є–њ–µ—А—В–Њ–љ–Є—П, —Б—В–µ–љ–Њ–Ї–∞—А–і–Є—П.
–Ф—А—Г–≥–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–Љ –њ—А—П–Љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ—Г—О –љ–µ—А–≤–љ—Г—О —В–Ї–∞–љ—М, —П–≤–ї—П—О—В—Б—П –≤–Є—В–∞–Љ–Є–љ—Л –≥—А—Г–њ–њ—Л –Т. –£—З–Є—В—Л–≤–∞—П –љ–µ–є—А–Њ—В—А–Њ–њ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Т1 (—В–Є–∞–Љ–Є–љ), –Т6 (–њ–Є—А–Є–і–Њ–Ї—Б–Є–љ), –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є—Е –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ. –≠—В–Є –≤–Є—В–∞–Љ–Є–љ—Л –Њ–±–ї–∞–і–∞—О—В –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ–Љ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В–Њ–≤, –љ–Њ –Є—Е –Њ–±—К–µ–і–Є–љ—П–µ—В –≤—Л—Б–Њ–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –і–ї—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є.
–Ґ–Є–∞–Љ–Є–љ (–≤–Є—В–∞–Љ–Є–љ –Т1) –љ–µ–Њ–±—Е–Њ–і–Є–Љ –і–ї—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ, –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –Є –±–µ–ї–Ї–Њ–≤–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є (—В–∞–±–ї. 2). –Ґ–∞–Ї–ґ–µ —В–Є–∞–Љ–Є–љ —П–≤–ї—П–µ—В—Б—П –Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–Љ –љ–µ–є—А–Њ–Љ—Л—И–µ—З–љ–Њ–є –њ–µ—А–µ–і–∞—З–Є. –Ю–љ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П —Б –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є M–—Е–Њ–ї–Є–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –∞ –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—Б—Б–Є—П –љ–∞—А—Г—И–∞–µ—В—Б—П –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ —В–Є–∞–Љ–Є–љ–∞ –њ–Є—А–Є—В–Є–∞–Љ–Є–љ–Њ–Љ [Goodman & Gilman, 1985]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —В–∞–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л, –Ї–∞–Ї –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–µ –љ–µ–≤—А–Є—В—Л, —Б–µ–љ—Б–Њ—А–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П —Б –≥–Є–њ–µ—А– –Є –≥–Є–њ–Њ—Б—В–µ–Ј–Є–µ–є, –і–µ–њ—А–µ—Б—Б–Є–Є, –њ–Њ—В–µ—А—П –њ–∞–Љ—П—В–Є, —П–≤–ї—П—О—В—Б—П –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –і–µ—Д–Є—Ж–Є—В–∞ —В–Є–∞–Љ–Є–љ–∞, —Г—Б—Г–≥—Г–±–ї—П—О—Й–µ–≥–Њ—Б—П –љ–∞ —Д–Њ–љ–µ —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ –Є–Љ–µ–µ—В –ї—Г—З—И—Г—О –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ–±—Л—З–љ—Л–Љ–Є –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —В–Є–∞–Љ–Є–љ–∞. –С–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ –Є–Љ–µ–µ—В –Љ–µ–љ—М—И–µ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є –±–Њ–ї—М—И—Г—О –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–Є–∞–Љ–Є–љ–Њ–Љ (–≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –Њ–±—Л—З–љ–Њ–≥–Њ —В–Є–∞–Љ–Є–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –љ–µ –±–Њ–ї–µ–µ 5% –Њ—В –њ—А–Є–љ—П—В–Њ–є –і–Њ–Ј—Л) [5].
–Я–Є—А–Є–і–Њ–Ї—Б–Є–љ (–≤–Є—В–∞–Љ–Є–љ –Т6) —Б–ї—Г–ґ–Є—В –Ї–Њ–—Д–∞–Ї—В–Њ—А–Њ–Љ –±–Њ–ї–µ–µ —З–µ–Љ 100 —Д–µ—А–Љ–µ–љ—В–∞–Љ, –≤–ї–Є—П–µ—В –љ–∞ —Б—В—А—Г–Ї—В—Г—А—Г –Є —Д—Г–љ–Ї—Ж–Є—О –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —А–µ–≥—Г–ї–Є—А—Г–µ—В –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О –±–µ–ї–Ї–Њ–≤–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –Є –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—О –Є–Ј–±—Л—В–Њ—З–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ –љ–µ–є—А–Њ—В—А–Њ–њ–љ–Њ–≥–Њ —П–і–∞ – –∞–Љ–Љ–Є–∞–Ї–∞. –Ь–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–Є–µ —Н—Д—Д–µ–Ї—В–Њ–≤ –њ–Є—А–Є–і–Њ–Ї—Б–Є–љ–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П—В—М –µ–≥–Њ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ (—В–∞–±–ї. 3).
–Э–∞ –њ–Њ—Б–ї–µ–і–љ–µ–Љ –Ї–Њ–љ–≥—А–µ—Б—Б–µ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –Р—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—О –і–Є–∞–±–µ—В–∞ (EASD) –≤ –Ь—О–љ—Е–µ–љ–µ –≤ 2004 –≥–Њ–і—Г –±—Л–ї–∞ –њ–Њ–і—З–µ—А–Ї–љ—Г—В–∞ –Њ–≥—А–Њ–Љ–љ–∞—П —А–Њ–ї—М –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ –≤ –ї–µ—З–µ–љ–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є. –Ю–≥—А–Њ–Љ–љ—Л–є –Є–љ—В–µ—А–µ—Б –≤—Л–Ј–≤–∞–ї–Є –і–∞–љ–љ—Л–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е —А–∞–±–Њ—В, –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ –≤ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–Є —А–∞–Ј–≤–Є—В–Є—П –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —А–µ—В–Є–љ–Њ–њ–∞—В–Є–Є. –Ґ–∞–Ї, —З–Є—Б–ї–Њ –∞—Ж–µ–ї–ї—О–ї—П—А–љ—Л—Е –Ї–∞–њ–Є–ї–ї—П—А–Њ–≤ –≤ –≥–ї–∞–Ј—Г, –њ—А–Є–љ—П—В–Њ–µ –Ј–∞ –µ–і–Є–љ–Є—Ж—Г –Є–Ј–Љ–µ—А–µ–љ–Є—П –њ–Њ—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Н–љ–і–Њ—В–µ–ї–Є—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П —Б–∞—Е–∞—А–∞, –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ –≤ —В–µ—З–µ–љ–Є–µ 36 –љ–µ–і–µ–ї—М –і–Њ—Б—В–Є–≥–ї–Њ —З–Є—Б–ї–∞ –љ–∞–±–ї—О–і–∞–µ–Љ—Л—Е —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–≤–Њ—В–љ—Л—Е, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є—Е —Б–ї—Г—З–∞—П—Е –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ –Љ–∞—Б—Б–Є—А–Њ–≤–∞–љ–љ–Њ–µ —А–∞–Ј—А—Г—И–µ–љ–Є–µ –њ–µ—А–Є—Ж–Є—В–Њ–≤ –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —А–µ—В–Є–љ–Њ–њ–∞—В–Є–є –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В –і–∞–љ–љ—Л–µ –њ—А–Њ—Д–µ—Б—Б–Њ—А–∞ –Э—М—О––Щ–Њ—А–Ї—Б–Ї–Њ–≥–Њ –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –Ї–Њ–ї–ї–µ–і–ґ–∞ –Є–Љ. –Р. –≠–є–љ—И—В–µ–є–љ–∞, –і–Њ–Ї—В–Њ—А–∞ –Ь.–С—А–∞—Г–љ–ї–Є –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ –њ–Њ–≤—Л—И–∞–µ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В—А–∞–љ—Б–Ї–µ—В–Њ–ї–∞–Ј—Л – –Ї–ї—О—З–µ–≤–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞, –Є–љ–∞–Ї—В–Є–≤–Є—А—Г—О—Й–µ–≥–Њ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л –Њ–±–Љ–µ–љ–∞ –≤–µ—Й–µ—Б—В–≤, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –Ї–ї–µ—В–Ї–Є –Є –Њ—А–≥–∞–љ—Л. –Т –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В—А–∞–љ—Б–Ї–µ—В–Њ–ї–∞–Ј—Л –њ–Њ–≤—Л—И–∞–µ—В—Б—П –љ–∞ 400%, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є —В–Є–∞–Љ–Є–љ–∞ – –ї–Є—И—М –љ–∞ 20%. –≠—В–Є —Б–≤–µ–і–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –њ—А–Њ—Д–µ—Б—Б–Њ—А—Г –Я. –Ъ–µ–Љ–њ–ї–µ—А—Г (–Т–µ–љ–≥—А–Є—П) –њ—А–µ–і–ї–Њ–ґ–Є—В—М –љ–Њ–≤—Л–є —В–µ—А–Љ–Є–љ, –Њ–±—К—П—Б–љ—П—О—Й–Є–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П: –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ – –∞–Ї—В–Є–≤–∞—В–Њ—А —В—А–∞–љ—Б–Ї–µ—В–Њ–ї–∞–Ј—Л.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –љ–∞ 80% —Г–Љ–µ–љ—М—И–Є—В—М —З–∞—Б—В–Њ—В—Г –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–Є –Є –њ—А–Њ—В–µ–Є–љ—Г—А–Є–Є. –Ю–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л, –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ—Г—О —А–Њ–ї—М –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ –≤ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–Є —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ, –±—Л–ї–Є –Њ–±–љ–∞—А–Њ–і–Њ–≤–∞–љ—Л –њ—А–Њ—Д–µ—Б—Б–Њ—А–Њ–Љ –®–µ–ї—М–≤—П–є–Ї (–Э–Є–і–µ—А–ї–∞–љ–і—Л). –Ґ–∞–Ї, –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –њ—А–Њ—В–µ–Є–љ–N––Ї–∞—А–±–Њ–Ї—Б–Є–Љ–µ—В–Є–ї–ї–Є–Ј–Є–љ–∞ (–Њ–і–љ–Њ–≥–Њ –Є–Ј —Б–∞–Љ—Л—Е —Б–Є–ї—М–љ—Л—Е –Є–љ–і—Г–Ї—В–Њ—А–Њ–≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞, –љ–∞–Ї–∞–њ–ї–Є–≤–∞—О—Й–µ–≥–Њ—Б—П –≤ –∞—А—В–µ—А–Є—П—Е –Є –∞—А—В–µ—А–Є–Њ–ї–∞—Е —Б–µ—А–і–µ—З–љ–Њ–є —В–Ї–∞–љ–Є) —Г –ґ–Є–≤–Њ—В–љ—Л—Е —Б —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ –≤—Л–Ј–≤–∞–љ–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤ 3,5 —А–∞–Ј–∞, —В–Њ–≥–і–∞ –Ї–∞–Ї —Г –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –Ї–Њ–љ–µ—З–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –≥–ї–Є–Ї–Є—А–Њ–≤–∞–љ–Є—П –і–∞–ґ–µ –љ–µ –±—Л–ї–Њ –љ–Є–Ї–∞–Ї–Є—Е —В–µ–љ–і–µ–љ—Ж–Є–є –Ї —А–∞–Ј–≤–Є—В–Є—О –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г—З–Є—В—Л–≤–∞—П –њ–∞—В–Њ–≥–µ–љ–µ–Ј —А–∞–Ј–≤–Є—В–Є—П –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є, —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ—Б–ї–µ–і–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –њ–Њ—З—В–Є —Г 100% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–µ –і–Є–∞–≥–љ–Њ–Ј–∞ —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ —Г–ґ–µ –Љ–Њ–ґ–љ–Њ –≤—Л—П–≤–Є—В—М –љ–∞—А—Г—И–µ–љ–Є—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Є/–Є–ї–Є —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –Є–љ–љ–µ—А–≤–∞—Ж–Є–Є, –њ—А–µ–њ–∞—А–∞—В—Л, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ (–Ь–Є–ї—М–≥–∞–Љ–Љ–∞ –і—А–∞–ґ–µ, –С–µ–љ—Д–Њ–≥–∞–Љ–Љ–∞), —Б—В–∞–љ–Њ–≤—П—В—Б—П —Б—А–µ–і—Б—В–≤–Њ–Љ –њ–µ—А–≤–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –ї–µ—З–µ–љ–Є–Є, –љ–Њ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —А–∞–Ј–≤–Є—В–Є—П –љ–µ –љ–µ–є—А–Њ–њ–∞—В–Є–Є, –∞ —В–∞–Ї–ґ–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —А–µ—В–Є–љ–Њ– –Є –љ–µ—Д—А–Њ–њ–∞—В–Є–Є.
–Э–∞–Є–±–Њ–ї–µ–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —П–≤–ї—П–µ—В—Б—П –∞–њ—А–Њ–±–Є—А–Њ–≤–∞–љ–љ–∞—П —Б—Е–µ–Љ–∞ —В—А–µ—Е—Б—В—Г–њ–µ–љ—З–∞—В–Њ–є —В–µ—А–∞–њ–Є–Є –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–∞—П –Ъ. –†–∞–є–љ–µ—А—Б–Њ–Љ –Є –У. –Ч–∞–Ї—Б–µ –≤ 2002 –≥–Њ–і—Г:
1 —Б—В—Г–њ–µ–љ—М – –Т—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –њ–Є—А–Є–і–Њ–Ї—Б–Є–љ–Њ–Љ (–Ь–Є–ї—М–≥–∞–Љ–Љ–∞) –њ–Њ 1 –і—А–∞–ґ–µ 3 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є –≤ —В–µ—З–µ–љ–Є–µ 2–4 –љ–µ–і–µ–ї—М. –Ч–∞—В–µ–Љ –њ—А–Є–µ–Љ –Ь–Є–ї—М–≥–∞–Љ–Љ—Л –њ—А–Њ–і–Њ–ї–ґ–∞—О—В –њ–Њ 1–2 –і—А–∞–ґ–µ –µ–ґ–µ–і–љ–µ–≤–љ–Њ.
2 —Б—В—Г–њ–µ–љ—М – –Я—А–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–µ—А–≤–Њ–є —Б—В—Г–њ–µ–љ–Є –Ї —В–µ—А–∞–њ–Є–Є –і–Њ–±–∞–≤–ї—П–µ—В—Б—П –Ґ–Є–Њ–≥–∞–Љ–Љ–∞ –µ–ґ–µ–і–љ–µ–≤–љ–Њ –њ–Њ 600 –Љ–≥ –Є–љ—Д—Г–Ј–Є–Њ–љ–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 2 –љ–µ–і–µ–ї—М*.
3 —Б—В—Г–њ–µ–љ—М – –Я—А–Є —В—П–ґ–µ–ї—Л—Е —Д–Њ—А–Љ–∞—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –њ—А–Є–µ–Љ –Ь–Є–ї—М–≥–∞–Љ–Љ—Л –і—А–∞–ґ–µ (–њ–Њ 1 –і—А–∞–ґ–µ 3 —А–∞–Ј–∞ –≤ –і–µ–љ—М) –Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Ґ–Є–Њ–≥–∞–Љ–Љ—Л –њ–Њ 600–1200 –Љ–≥ –≤ —Б—Г—В–Ї–Є. –Ґ–µ—А–∞–њ–Є—О –њ—А–Њ–≤–Њ–і–Є—В—М –љ–µ –Љ–µ–љ–µ–µ 2–4 –љ–µ–і–µ–ї—М.
–Э–∞—А—П–і—Г —Б –Ґ–Є–Њ–≥–∞–Љ–Љ–Њ–є –Є –Ь–Є–ї—М–≥–∞–Љ–Љ–Њ–є –і–ї—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ—Г—В–Њ–ї—П—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —В–∞–Ї–ґ–µ –Љ–∞–Ј–Є —Б –Ї–∞–њ—Б–∞–Є—Ж–Є–љ–Њ–Љ, —В—А–Є—Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є–µ –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В—Л, –Ї–∞—А–±–∞–Љ–∞–Ј–µ–њ–Є–љ, –≥–∞–±–∞–њ–µ–љ—В–Є–љ.
–Я—А–Є —А–∞–Ј–≤–Є—В–Є–Є —Б–Є–љ–і—А–Њ–Љ–∞ «–Ф–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П —Б—В–Њ–њ–∞» –Ї —В–µ—А–∞–њ–Є–Є –њ–Њ–і–Ї–ї—О—З–∞—О—В –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –і–µ–є—Б—В–≤–Є—П, —А–µ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—В–≤–Њ—А—Л, –і–µ–Ј–∞–≥—А–µ–≥–∞–љ—В—Л, –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л [1,3].
–Ю–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ –њ—А–∞–≤–Є–ї—М–љ–Њ–≥–Њ –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —П–Ј–≤–µ–љ–љ—Л–Љ–Є –і–µ—Д–µ–Ї—В–∞–Љ–Є —Б—В–Њ–њ —П–≤–ї—П–µ—В—Б—П –њ—А–∞–≤–Є–ї—М–љ–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ —А–∞–љ: —Г–і–∞–ї–µ–љ–Є–µ –≥–Є–њ–µ—А–Ї–µ—А–∞—В–Њ–Ј–∞, –Њ—З–Є—Й–µ–љ–Є–µ —А–∞–љ—Л –Њ—В —Б—В—А—Г–њ–∞; —А–∞–љ—Г –≤–µ—Б—В–Є –Њ—В–Ї—А—Л—В–Њ–є, —Б–Њ–Ј–і–∞–≤–∞—П –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–є –Њ—В—В–Њ–Ї —Н–Ї—Б—Б—Г–і–∞—В–∞ –Є–Ј —А–∞–љ—Л; —А–∞–љ–∞ –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –≤–ї–∞–ґ–љ–Њ–є; –Є–Ј–±–µ–≥–∞—В—М —В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ–µ—А–µ–≤—П–Ј–Њ–Ї; –њ—А–Њ–Љ—Л–≤–∞–љ–Є–µ —А–∞–љ—Л —А–∞—Б—В–≤–Њ—А–∞–Љ–Є, –љ–µ—В–Њ–Ї—Б–Є—З–љ—Л–Љ–Є –і–ї—П –≥—А–∞–љ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–є —В–Ї–∞–љ–Є (—А–—А—Л –і–Є–Њ–Ї—Б–Є–і–Є–љ–∞, –Љ–Є—А–∞–Љ–Є—Б—В–Є–љ–∞, —Е–ї–Њ—А–≥–µ–Ї—Б–Є–і–Є–љ–∞, —Д—Г—А–∞—Ж–Є–ї–Є–љ–∞, —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є); –Љ–∞–Ј–Є:
–Щ–Њ–і–Њ–њ–µ—А–Њ–ї–Њ–≤–∞—П, –Ы–µ–≤–Њ–Љ–Є–Ї–Њ–ї—М, –Ы–µ–≤–Њ—Б–Є–љ; –љ–∞ —Б—В–∞–і–Є–Є –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П –Љ–∞–Ј—М «–Ш—А—Г–Ї—Б–Њ–ї». –Э–Х–Ы–ђ–Ч–ѓ – –є–Њ–і, —Б–њ–Є—А—В, –Љ–∞—А–≥–∞–љ—Ж–Њ–≤–Ї–∞, –і–µ—А–ґ–∞—В—М —А–∞–љ—Г –њ–Њ–і —Б—В—А—Г–њ–Њ–Љ!
–Э–µ –Љ–µ–љ–µ–µ –≤–∞–ґ–љ–Њ–є, —З–µ–Љ –≤—Б–µ –њ—А–Њ–≤–Њ–і–Є–Љ—Л–µ —А–∞–љ–µ–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П, —П–≤–ї—П–µ—В—Б—П —А–∞–Ј–≥—А—Г–Ј–Ї–∞ –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є (–њ–Њ—Б—В–µ–ї—М–љ—Л–є —А–µ–ґ–Є–Љ –љ–∞ 2 –љ–µ–і–µ–ї–Є, –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ – –љ–Њ—И–µ–љ–Є–µ –Њ—А—В–Њ–њ–µ–і–Є—З–µ—Б–Ї–Њ–є –Њ–±—Г–≤–Є).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г—Б–њ–µ—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –≤—Л—П–≤–ї–µ–љ–Є—П —Н—В–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –Є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –њ–Њ–і—Е–Њ–і–µ, –≤–Ї–ї—О—З–∞—О—Й–µ–Љ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О —Г—А–Њ–≤–љ—П –≥–ї–Є–Ї–µ–Љ–Є–Є –Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—Й–Є—Е –љ–∞ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —А–∞–Ј–≤–Є—В–Є—П –Ф–Я–Э, —В–∞–Ї–Є–µ –Ї–∞–Ї –њ—А–µ–њ–∞—А–∞—В—Л –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ (–Ь–Є–ї—М–≥–∞–Љ–Љ–∞ –і—А–∞–ґ–µ, –С–µ–љ—Д–Њ–≥–∞–Љ–Љ–∞) –Є —В–Є–Њ–Ї—В–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Ґ–Є–Њ–≥–∞–Љ–Љ–∞).
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р–љ—Ж–Є—Д–µ—А–Њ–≤ –Ь.–С., –Ґ–Њ–Ї–Љ–∞–Ї–Њ–≤–∞ –Р.–Ѓ., –У–∞–ї—Б—В—П–љ –У.–†., –£–і–Њ–≤–Є—З–µ–љ–Ї–Њ –Ю.–Т. –°–Є–љ–і—А–Њ–Љ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ—Л. 2002;
2. –У–∞–ї—Б—В—П–љ –У.–†., «–Ф–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є—П», 2000 –≥.
3. –У—Г—А—М–µ–≤–∞ –Ш.–Т. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞, –ї–µ—З–µ–љ–Є–µ, –Љ–µ–і–Є–Ї–Њ–—Б–Њ—Ж–Є–∞–ї—М–љ–∞—П —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є—П –Є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є—П –Љ–µ–і–Є–Ї–Њ–—Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ —Б —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ—Л. –Ф–Є—Б—Б.–і–Њ–Ї—В.–Љ–µ–і.–љ–∞—Г–Ї., –Ь., 2001
4. –Ъ–Њ—В–Њ–≤ –°.–Т., –Ъ–∞–ї–Є–љ–Є–љ –Р.–Я., –†—Г–і–∞–Ї–Њ–≤–∞ –Ш.–У.. –Ф–Є–∞–±–µ—В–Є—З—Б–µ–Ї–∞—П –љ–µ–є—А–Њ–њ–∞—В–Є—П, 2000., –°175–178
5. –Ы–µ—З–µ–љ–Є–µ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ. –Ь–Є–ї—М–≥–∞–Љ–Љ–∞. –Э–∞—Г—З–љ—Л–є –Њ–±–Ј–Њ—А. –Т—С—А–≤–∞–≥ –§–∞—А–Љ–∞ –У–Љ–±–• –Є –Ъ–Њ., 2004 –≥–Њ–і
6. –Ф–µ–і–Њ–≤ –Ш.–Ш., –®–µ—Б—В–∞–Ї–Њ–≤–∞ –Ь.–Т.. –°–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В. –Ь–Њ—Б–Ї–≤–∞, 2003
7. –Ґ–µ—А–∞–њ–Є—П –∞–ї—М—Д–∞––ї–Є–њ–Њ–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є. –Ґ–Є–Њ–≥–∞–Љ–Љ–∞. –Э–∞—Г—З–љ—Л–є –Њ–±–Ј–Њ—А. –Т—С—А–≤–∞–≥ –§–∞—А–Љ–∞ –У–Љ–±–• –Є –Ъ–Њ., 2003–≥–Њ–і
8. Dyck P.J., Karnes J.L., O’Brien P.C. The Rochester Diabetic Neuropathy Study: reassessment of tests and criteria for diagnosis and staged severity. Neurology, 1992; 42; 1164–1170;
9. Dyck P.J., Litchy W.J., Lehman N.A., Nokanson J.L. et al. Variables influences neuropathic endpoints. The Rochester Diabetic Neuropathy Study of Heaithy Subjects. Neurology, 1995, 45: 1115–1121
10. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of Diabetes on the development and progression og long–term complication in insulin–dependent diabetes mellitus N.Engl. J.Med 1993; 70: 1009–1018
11. Ziegler D. Diagnosis and Management of Diabetic Peripheral Neuropahty. Diabetic Medicine, 1996, 13; P 34– 38
–Р–Т–Ґ–Ю–†–Ђ:
–Ф–ґ–∞–љ–∞—И–Є—П –Я.–•., –Ь–Є—А–Є–љ–∞ –Х.–Ѓ., –У–∞–ї–Є–µ–≤–∞ –Ю.–†.

–°–≤–µ–ґ–Є–µ —Б—В–∞—В—М–Є
- –Ъ—Г–њ–Є—В—М Freestyle Libre
- –Ь–Њ–ґ–љ–Њ –ї–Є –Ј–∞–Љ–µ–љ–Є—В—М —Г–Ї–Њ–ї—Л –љ–µ–Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є —Б–њ–Њ—Б–Њ–±–∞–Љ–Є –≤–≤–µ–і–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞ –Є –≥–ї—О–Ї–Њ–Љ–µ—В—А–Є–Є?
- –Э–µ–Њ–љ–∞—В–∞–ї—М–љ—Л–є —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В
- –Ы–Є–њ–Њ–∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–є —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В
- –І—В–Њ —В–∞–Ї–Њ–µ –њ—А–µ–і–Є–∞–±–µ—В –Є –њ–Њ—З–µ–Љ—Г –Њ–љ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В?
–І–Є—В–∞–є—В–µ —В–∞–Ї–ґ–µ:


 —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В
—Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В 05.07.2014
05.07.2014